Ein wichtiger Schritt zur Fernsteuerung bioaktiver Moleküle?
Ein ferngesteuertes Schaltkonzept zum selektiven Ein- und Ausschalten von Proteinen mittels Ultraschall
Die Anwendungsmöglichkeiten von Ultraschall sind vielseitig und zahlreich. So wird er aufgrund seiner Biokompatibilität unter anderem in medizinisch-therapeutischen und bei in vivo-bildgebenden Verfahren genutzt. Außerdem wird Ultraschall dazu verwendet, gezielt Kettenspaltungen in synthetischen Polymerketten hervorzurufen, um deren Eigenschaften und Funktionen zu beeinflussen. Vor diesem Hintergrund wäre es ein großer Schritt, auch biologische Makromoleküle, wie beispielsweise Proteine, mittels Ultraschall so anzusprechen, dass ihre optischen oder katalytischen Eigenschaften einfach aktiviert und deaktiviert werden können.
Ein erster Durchbruch in diesem Bereich ist einem Forscherteam aus Deutschland und den Niederlanden gelungen. Den Wissenschaftlern, unter ihnen Prof. Dr. Andreas Herrmann, Dr. Robert Göstl, und Dr. Arnold Boersma vom DWI – Leibniz-Institut für Interaktive Materialien, ist es gelungen, die Funktion gentechnisch hergestellter Proteine mit Hilfe von Ultraschall ein- und auszuschalten. Dazu fügten sie der nativen Struktur der Proteine weitere lange und hochgeladene Domänen hinzu, wodurch diese responsiv gegenüber den von Ultraschall induzierten Scherkräften wurden.
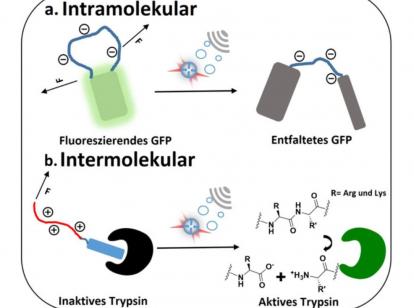
Am Beispiel von GFP (grün fluoreszierendem Protein), einem häufig genutztem Markerprotein, konnten die Forscher zeigen, dass die eingefügte Domäne durch die mechanische Krafteinwirkung von Ultraschall destabilisiert wird. Dadurch verlor das Protein seine Fähigkeit, grün zu fluoreszieren. Die Sekundärstruktur des Proteins blieb jedoch erhalten. Durch den gezielten Einbau dieser Domäne konnten die Wissenschaftler dem ansonsten ultraschall-stabilen Protein einen ultraschall-sensitiven „Ausschalter“ hinzufügen.
Darüber hinaus bewies das Forscherteam am Beispiel von Trypsin, einer Protease des Verdauungssystems, dass die Aktivität von Proteinen durch Ultraschalleinwirkung nicht nur deaktiviert, sondern auch aktiviert werden kann. Dazu fusionierten sie eine geladene lange Domäne mit einem Peptid, das die Aktivität des Enzyms hemmt. Durch die Anwendung von Ultraschall konnte die Protein-Protein-Wechselwirkung zwischen Enzym und Inhibitor erfolgreich unterbrochen und das aktivierte Enzym freigesetzt werden.
Somit haben die Forscher das erste molekulare Konzept zur Aktivierung und Deaktivierung der optischen und katalytischen Aktivitäten gentechnisch hergestellter Proteine in Lösung etabliert, indem Ultraschall und damit Scherkraft als Auslöser benutzt wurde. Die Nutzung externer Stimuli zur Steuerung der Proteinfunktion wird immer relevanter, wie das wachsende Feld der Optogenetik und dessen Einfluss auf die Neurowissenschaften und andere Bereiche zeigen.
Das Forscherteam glaubt durch diese Erkenntnisse außerdem, eine erste wichtige Grundlage für die Fernsteuerung von Proteinaktivitäten in vivo, also beispielsweise im menschlichen Körper, gelegt und somit neues Potenzial zur Entwicklung innovativer, nicht-invasiver, biokompatibler medizinischer Therapien und in vivo-bildgebenden Verfahren geschaffen zu haben.