Zellmembranen nachahmen, um biologische Vorgänge und Funktionen besser zu verstehen
Dr. Nina Kostina ist Wissenschaftlerin am DWI – Leibniz-Institut für Interaktive Materialien und forscht in der Gruppe um Dr. César Rodriguez-Emmenegger. Zusammen mit Dominik Söder, Anna Wagner, Anton Joseph (Doktoranden der AG Rodriguez-Emmenegger) und Dr. Tamás Haraszti (Projektleiter am DWI) arbeitet sie an der Entwicklung vollständig synthetischer Zellen, sogenannter „Proto-Zellen“. Die Forscherinnen und Forscher verfolgen dabei die Absicht, Prozesse und Vorgänge, die in echten biologischen Zellen ablaufen, nachzuahmen und zu untersuchen. Diese minimalistischen Zellen dienen als Modell, komplexe biologische Prozesse – bis hin zur Frage nach dem Ursprung des Lebens – zu analysieren und zu entschlüsseln.
Ziele dieser Forschungsarbeiten sind das Design und die Herstellung synthetischer Bausteine, die sich selbst zu Vesikeln, also membranumbundenen Bläschen, zusammenschließen können und wesentliche Eigenschaften von Zellmembranen nachahmen. Das Hauptaugenmerk gilt dabei der Interaktion mit belebter Materie und der Fragestellung, wie zum Beispiel Teilung und Kommunikation, in diesen synthetischen Zellen programmiert werden können. Das Forschungsteam hat dabei jüngst große Fortschritte erzielt und ihre Arbeiten wurden in renommierten Fachzeitschriften wie Angewandte Chemie, PNAS, Nano Letters und Soft Matter (ausgewählt für die thematische Sammlung ʺRemodellierung von Biomembranen“ und vorgestellt auf der Titelseite) veröffentlicht.
Die Vielseitigkeit und Aufgaben der Zellmembran
Zellmembranen haben zahlreiche Funktionen und Aufgaben, die auf den ersten Blick teilweise widersprüchlich erscheinen. So dienen sie als mechanische Barriere und Abgrenzung zum Schutz vor äußeren Einflüssen. Auf der anderen Seite nehmen sie Reize aus der Umgebung auf und leiten somit gezielt Signale ins Zellinnere. Darüber hinaus versorgen sie die Zelle mit Nährstoffen. Schließlich vermitteln sie mechanische Eigenschaften, die die Flexibilität und Beweglichkeit der Zelle ermöglichen.
Der Aufbau und die Struktur der Zellmembran muss also vielseitig und komplex sein, sodass schnell einige Fragen aufkommen: Woraus besteht eine Zellmembran eigentlich? Und wie schafft sie es, eine so große Bandbreite an Funktionen zu erfüllen? "Die Zellmembran ist ein sehr komplexes Organell, vereinfacht gesagt ein „Organ der Zelle“, und besteht zu fast 80% aus Lipiden, die restlichen Anteile machen unter anderem Proteine aus. Die äußerste Grenzfläche der Zelle ist die Glykokalyx. Sie besteht aus komplexen Organisationen von zuckerhaltigen Bausteinen, wie Glykolipiden und Glykoproteinen. Es überrascht also nicht, dass sie die erste „Zell-Komponente“ ist, die mit der Umgebung interagiert und sehr wichtige zelluläre Aufgaben ermöglicht. Dazu gehören zum Beispiel die Kommunikation, die Nährstoffversorgung, die Signal-Weiterleitung und Interaktionen mit der extrazellulären Matrix", erklärt Nina Kostina. ʺAufgrund der komplexen Struktur ist es jedoch fast unmöglich, die einzelnen Funktionen separat zu betrachten und zu untersuchenʺ, sagt sie. "Um dies zu ermöglichen, müssen wir ein neues Modellsystem entwickeln, das die Eigenschaften von Zellmembranen nachahmt und die Einbindung biologischer Bausteine erlaubt", erklärt die Chemikerin.
Dendrimersome: Synthetische Vesikel mit besonderen Eigenschaften
Aufgrund der hohen Komplexität von Biomembranen müssen bei der Erstellung eines künstlichen Membranmodells viele Faktoren berücksichtigt werden. Der Einbau von biologischen Bausteinen setzt voraus, dass die Dicke der Membran identisch mit der einer natürlichen Zellmembran ist, also immer zwischen 4 und 6 Nanometer beträgt. Diese biologischen Bausteine sollten sich frei über die Membran bewegen können. Dies wird auch als laterale Mobilität bezeichnet. Sie muss also extrem flexibel und dennoch stabil sein. Ein solch dünnes Konstrukt stabil zu gestalten, ohne dabei an Flexibilität zu verlieren, war jedoch in den letzten Jahren eine Mammutaufgabe für die Forscherinnen und Forscher.
Um diese Herausforderung zu bewältigen, arbeitet das DWI-Forscherteam mit der Gruppe von Prof. Virgil Percec (University of Pennsylvania), einem der Pioniere auf dem Gebiet der "Janus-Dendrimere" (JD) zusammen. Analog zum antiken römischen Gott Janus besitzen diese Moleküle zwei ʺGesichterʺ - sogenannte Dendrons -, die an der gegenüberliegenden Seite des "verzweigten Kerns" angebracht sind. Somit werden zwei gegensätzliche Funktionalitäten: wasserliebend (hydrophil) und wasserabweisend (hydrophob) in ein und demselben Molekül miteinander verknüpft. In wässriger Lösung lagern sich die JD selbstständig zu sogenannten Vesikeln zusammen. Fachleute bezeichnen diesen Prozess als "Selbst-Assemblierung". Im Fall von JD werden die entstehenden Vesikel auch als Dendrimersome bezeichnet. Das Schöne an der Nutzung von JD ist, dass die Eigenschaften des Dendrimersoms während der Synthese in die Struktur „einprogrammiert“ werden können.
Den Forscherinnen und Forschern ist es bereits gelungen, diese synthetischen Vesikel mit vielversprechenden Eigenschaften wie einer Membrandicke von 4 bis 6 Nanometern, hoher Flexibilität, lateraler Mobilität und Stabilität herzustellen. Die Kombination dieser Eigenschaften macht Dendrimersome zu Zellmembranmodellen, die über die üblicherweise verwendeten Zellmembran-Imitatoren, wie sogenannte Liposomen und Polymersomen, hinausgehen.
Wie sich Formveränderungen an Zellmembranen nachahmen lassen
Ein Ziel, welches das Forschungsteam verfolgt, ist im Membran-Modell Formveränderungen herbeizuführen, wie sie natürlicherweise bei Zellen in verschiedenen Situationen vorkommen. Die lebenswichtigen Funktionen von Zellmembranen erfordern die Fähigkeit, ihre Form verändern zu können, um komplexe Aufgaben wie Bewegung, Teilung und die Stoffaufnahme durch Einstülpung der Membran zu erfüllen. All diese Änderungen der Zellform werden durch sehr komplexe Prozesse angetrieben, wie z. B. durch Änderungen der Lipidzusammensetzung, die Aneinanderreihung von krümmungsstabilisierenden Proteinen und die reversible Einfügung von Proteinbereichen, die wie Keile in der Membran wirken. Aber könnten auch viel einfachere Mechanismen die Formveränderung der Membran unterstützen?
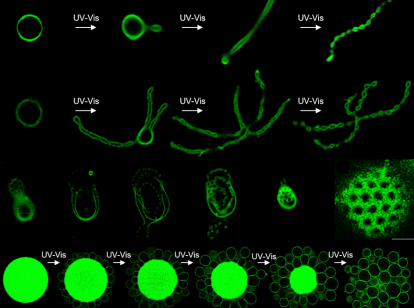
Um diese Frage zu beantworten, ging das Forscherteam bei der Entwicklung der Dendrimersome noch einen Schritt weiter: Sie generierten zwei JD-Varianten. Eine wurde chemisch so gestalten, dass mit Hilfe von ultraviolettem (UV) bzw. sichtbarem (vis) Licht der große Teil des hydrophilen Zweigs abgespalten wird, wodurch das JD nicht mehr zylindrisch, sondern keilförmig in der Membran vorliegt. Die andere Variante ist unter den gleichen Lichteinflüssen stabil und behält ihre zylindrische Form bei. Nach der Selbst-Assemblierung dieser beiden Varianten zu Vesikeln konnten die Wissenschaftlerinnen und Wissenschaftler deren Form durch Bestrahlung mit UV-vis-Licht beeinflussen. Die Abspaltung eines Teils der Moleküle in den Vesikeln verändert deren dreidimensionale Form und führt zu einer deutlich kleineren hydrophilen Fläche auf der Membran. Dadurch schrumpft die Gesamtfläche der Membran und reduziert das Volumen des Vesikels. Darüber hinaus erlaubt die hohe laterale Mobilität der zylinderförmigen JD eine örtliche Konzentrierung in der Membran und erzwingt so eine Asymmetrie, die ebenfalls eine Krümmung in der Membran hervorruft. Verschiedene Formtransformationen, die in Zellen und ihren Organellen allgegenwärtig sind, wie beispielsweise Knospung, Teilung und Porenbildung, konnten somit auch in Dendrimersomen beobachtet werden und zwar direkt unter dem Mikroskop. Einige Vesikel bilden eine Art Perlenkette, während andere einer von Kinderhand gezeichneten Blume ähneln.
Eine der wichtigsten Beobachtungen, die die Wissenschaftler in dieser Arbeit gemacht haben: Nach Lichteinwirkung bildet sich eine kleine Ausstülpung aus der Dendrimersom-Membran, die zu einer langen Röhre heranwächst und sich schließlich in ein Perlenketten-artiges Vesikel verwandelt. Doch was ist das Besondere daran? Genau dieser Vorgang erinnert an Prozesse, die bei der natürlich vorkommenden zellulären Apoptose, die als "programmierter Zelltod" verstanden wird, zu beobachten sind. Wenn sich Zellen entscheiden, Apoptose zu begehen, also die Selbstzerstörung einzuleiten, durchlaufen sie die gleichen Formveränderungen, wie sie in den Dendrimersomen beobachtet werden. Einer der Mechanismen, die die Formtransformationen während der Apoptose vorantreiben, beinhaltet die enzymatische Spaltung von zylindrischen Lipiden (Sphingomyelin) in keilförmige Lipide (Ceramid). Somit basieren beide Vorgänge auf einem ähnlichen Prinzip und die Ergebnisse stellen eine wertvolle Grundlage für die Untersuchung von realen zellulären Membranprozessen dar.
Wie beeinflussen die molekularen Muster der Glykokalyx ihre biologische Aktivität?
In einem weiteren Forschungsprojekt beschäftigten sich die Forscherinnen und Forscher mit der Frage, wie die in der Glykokalyx vorhandenen molekularen Muster ihre biologische Aktivität beeinflussen. Die Bandbreite und hohe Komplexität der Funktionen der zellulären Glykokalyx ergeben sich aus der Kombination der chemischen Vielfalt der Zuckereinheiten und ihrer räumlichen, dreidimensionalen Anordnung, die die Affinität in der Zucker-Protein-Interaktion steuern. Die Zuckereinheiten an der Zellmembran sind in einzigartigen molekularen Mustern organisiert, die die Zelle unter anderem als körpereigen definieren, aber auch von pathogenen Bakterien und Viren ausgenutzt werden, um die Zellen anzugreifen. Es ist also nicht verwunderlich, dass der Glykokalyx viel Aufmerksamkeit gewidmet wird. Wissenschaftlerinnen und Wissenschaftler versuchen zu klären, wie sich die Funktion aus der räumlichen Anordnung der Zuckergruppen an der Zellmembran ergibt. Doch trotz jahrzehntelanger Arbeit ist die Struktur der Glykokalyx in Zellen aufgrund der begrenzten Möglichkeiten für bildgebende Verfahren, selbst mit den modernsten ultrahochauflösenden Mikroskopen, schwierig aufzuklären.
Vor kurzem hat die Gruppe um Dr. César Rodriguez-Emmenegger, wiederum zusammen mit der Gruppe von Prof. Virgil Percec, spezielle Glykodendrimersome entwickelt. Dies sind Dendrimersome, die Zuckerbausteine außerhalb der Membran tragen. Für diese Arbeit wurde die einfachste Zuckergruppe – Mannose – aufgrund ihrer hohen biologischen Relevanz und Präsenz in der zellulären Glykokalyx ausgewählt. Nachdem sich die Mannose-dekorierten JD selbst zu Vesikeln zusammengefügt hatten, analysierte das Forschungsteam deren Membranen genau und fand heraus, dass sich die Zuckerbausteine in einer sehr eigenartigen Weise auf der Membran, wie in einem Mosaikmuster, anordnen. Bei den Untersuchungen fanden sie heraus, dass diese speziellen Muster des Zuckers die Bindungsaffinität zu Concanavalin A dramatisch erhöhen. Concanavalin A ist ein Protein, das spezifisch Mannose bindet und unter anderem bereits in der immunologischen Forschung eingesetzt wird.
Das Verständnis über die Bildung von periodischen Glykan-Nanoarrays, also den Mosaik-Mustern der Glykokalyx, kann dazu beitragen, die Abläufe bei der Zellkommunikation, der Signalübertragung und dem Vesikel-Transport innerhalb der Zellen besser zu verstehen. Es stellt ein eindrucksvolles Beispiel dafür dar, wie die Funktionen von der Struktur beeinflusst werden können. Von besonderem Interesse ist es, wie verschiedene molekulare Anordnungen die biologische Erkennung bestimmen. Dieses Wissen kann in der Biomedizin von großer Bedeutung für die Entwicklung von Therapeutika sein, die zwischen Wirtszellen und Krankheitserregern wie Viren oder Bakterien unterscheiden.