Ultraschall zur Verbesserung von therapeutischen Nukleinsäuren
Aman Ishaqat, Wissenschaftlerin am DWI – Leibniz-Institut für Interaktive Materialien, forscht in der Arbeitsgruppe von Prof. Andreas Herrmann im Bereich der therapeutischen Nukleinsäuren. Diese haben ein enormes Potential für die Behandlung einer Vielzahl von Krankheiten, die beispielsweise Nerven schädigen oder zu verstärktem Muskelabbau führen. Mit ihrer Forschung will Aman dazu beitragen, die Anwendungsmöglichkeiten der Nukleinsäuren zu erweitern sowie ihre klinisch-therapeutische Nutzung effizienter zu gestalten.
Spätestens seit dem Beginn der vorherrschenden Pandemie, hervorgerufen durch das Coronavirus SARS-CoV-2, horchen alle aufmerksam auf, wenn es um den Begriff RNA geht. So schleust das membranumhüllte Virus die eigene RNA am Zielort, beispielsweise im Lungengewebe des menschlichen Körpers, ein und richtet Unheil an. Aber auch in der Impfstoffforschung wird sich RNA zunutze gemacht und dient dabei als Bauplan für Virenbestandteile, genauer gesagt Proteine. Diese induzieren eine Aktivierung des Immunsystems und bereiten den Körper so auf einen Ernstfall vor. Des weiteren finden die Nukleinsäuren seit längerem auch Anwendungen im klinisch-therapeutischen Bereich. Dabei ergeben sich im Laufe der Zeit immer mehr Möglichkeiten für neue Therapieansätze.
Doch was ist so besonders an therapeutischen Nukleinsäuren?
Therapeutische Nukleinsäuren sind im Grunde genetische Informationen beziehungsweise Baupläne, die sowohl aus DNA als auch RNA, also Desoxy- bzw. Ribonukleinsäure, bestehen können. Diese bieten neue Möglichkeiten bei der Behandlung einer Vielzahl menschlicher Krankheiten. Einige dieser Krankheiten waren bisher mit konventionellen Medikamenten oder Proteinen nicht zu behandeln, beispielsweise aufgrund fehlender Möglichkeiten, den Krankheitsursprung oder die Wirkungsorte gezielt zu adressieren. Weitere Vorteile der RNA-Therapeutika sind deren vergleichsweise rasche Herstellung sowie die Möglichkeit, ihre Gensequenzen schnell und gezielt zuschneiden zu können. Trotz ihres Potentials gibt es jedoch viele Herausforderungen, die angegangen werden müssen, um einen größeren Erfolg von therapeutischen Nukleinsäuren in klinischen Anwendungen zu erzielen. Amans Forschungsarbeiten gehen einige dieser Herausforderungen an. So sollen die Therapeutika in kontrollierter Weise am richtigen Ort des menschlichen Körpers zu einem gewünschten Zeitpunkt und in der nötigen Dosis verabreicht werden. Dabei können die Nukleinsäuren verwendet werden, um bestimmte Prozesse innerhalb der Zelle entweder zu stimulieren oder zu hemmen. Die möglichen Anwendungsgebiete neuer Therapieansätze erstrecken sich über den Bereich der Sonopharmakologie, bei der die Aktivierung von Wirkstoffen im Fokus steht, bis hin zum Bereich der Sonogenetik, bei dem Protein- und Genfunktionen an- und ausgeschaltet werden.
Der Weg in unseren Körper
Um sicherzustellen, dass die Nukleinsäuren die gewünschte Funktionen verrichten können, müssen diese auf schonende Weise zur Zielstelle im Körper gebracht werden. Vor allem RNA gilt eher als unstabiles Molekül und kann leicht durch allgegenwärtige Enzyme abgebaut werden. Um diese Problematik zu umgehen, behilft sich Aman mit strukturellen Modifikationen und sogenannten Transportsystemen. Dabei werden beispielsweise winzig kleine Nanostrukturen verwendet, die an die jeweiligen Enden der mRNA (messenger, zu deutsch Boten-RNA) gepackt werden können, um diese vor ungewolltem Abbau oder Zerfall zu schützen. In einem anderen Ansatz werden speziell für diesen Zweck synthetisierte DNA-Nanostrukturen mit Polymeren kombiniert. Diese helfen einerseits den vorgesehenen Wirkungsort unbeschadet zu erreichen und andererseits bilden sie die Schnittstelle zu Oberflächen und Membranen am Zielort.
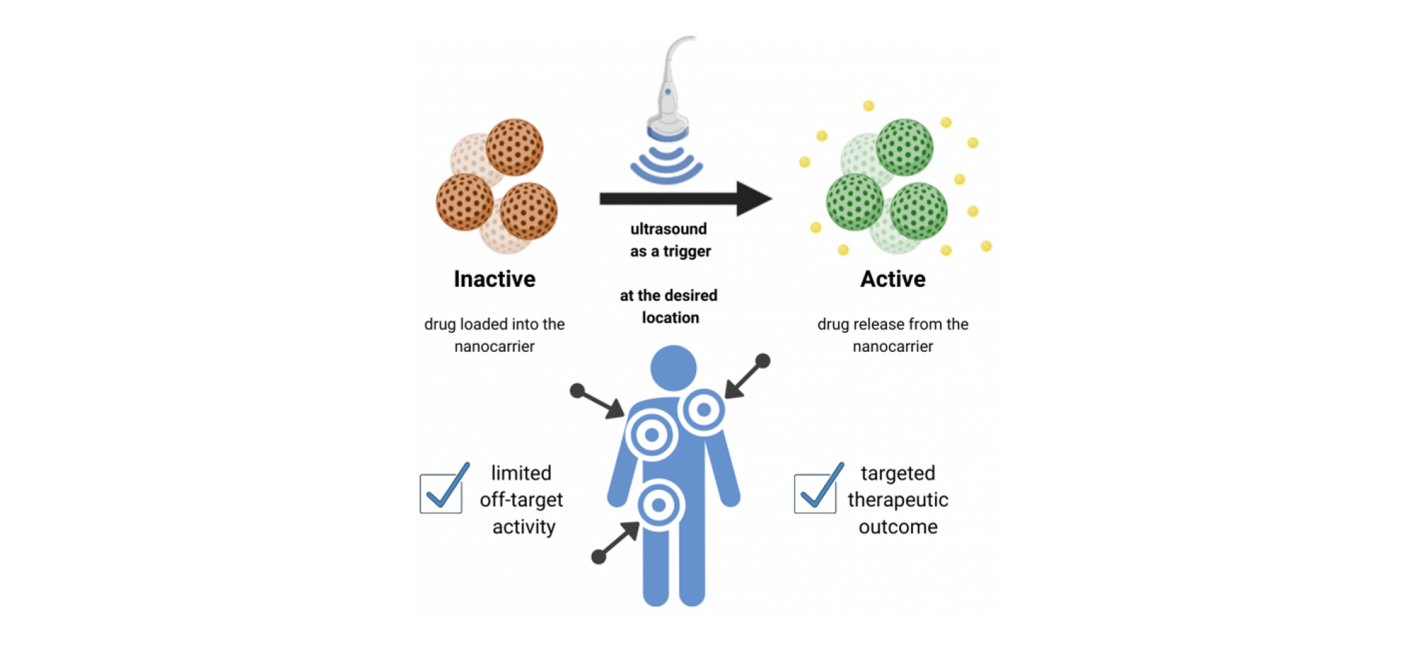
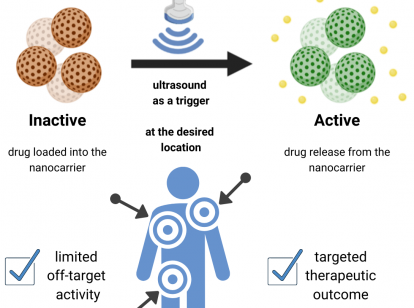
Smart drug delivery systems
Sobald die RNA-Moleküle am gewünschten Ort angekommen sind, sollen diese Modifikationen dann mittels Niedrigenergie-Ultraschall, welcher auch in zahlreichen anderen klinischen Anwendungen genutzt wird, gezielt abgetrennt werden. Dieses Funktionsprinzip wird smart drug delivery system genannt und macht sich DNA-basierte Nanotechnologie zunutze. Die gezielte Trennung vom Transportmolekül und die daraus resultierende Freisetzung der therapeutischen Nukleotide bietet so einen nicht-invasiven Ansatz für die Behandlung von Krankheiten. Das Transportsystem ist also so konzipiert, dass es Therapeutika bindet und diese dabei zugleich inaktivieren und schützen kann, bis die Freisetzung durch Ultraschall von außerhalb des Körpers ausgelöst wird.
Amans Ziel ist es, ein System zu entwickeln, um therapeutische Nukleinsäuren gezielt an bestimmte Gewebe im menschlichen Körper zu senden, wo sie unterschiedliche Wirkungen entfalten können. Unter anderem nutzt sie ein DNA-Konstrukt, welches das Immunsystem stimuliert und zusammen mit Antigenen für die Krebsimmuntherapie eingesetzt werden könnte. Ein weiterer Schwerpunkt ihrer Arbeit ist die Nutzung spezieller siRNA (small interfering RNA, zu deutsch: kleine eingreifende RNA), die zum Gen‑Knockdown verwendet werden kann. Das bedeutet, dass ein bestimmtes Zielgen ausgeschaltet und dessen Expression, also die daraus folgende Bildung der dazugehörigen Proteine, in der Zelle verhindert wird.
Maximierung der Wirkstoffeffizienz und Minimierung der Nebenwirkungen
Die Zahl der zugelassenen Medikamente, die zur Klasse der therapeutischen Nukleinsäuren gehören, und für den Einsatz bei Menschen geeignet sind, ist sehr begrenzt. Die laufende Forschung nach Systemen, die für die effiziente Verabreichung von Nukleinsäuren verwendet werden können, birgt viel Potential. Dieses umfasst zukünftige medizinische Therapien zur Behandlung vieler Krankheiten, darunter Krebs, Infektionen sowie genetische Defekte. Auf dem Gebiet der Krebsimmuntherapie ist die Stimulierung des Immunsystems für die Bekämpfung von Krebszellen einer der neuesten Ansätze zur Krebsbehandlung. Ferner noch könnten durch die Nutzung von siRNA Gene gezielt ausgeschaltet werden, um Krankheiten zu therapieren, bei denen ein Gendefekt zur Überproduktion eines bestimmten Proteins führt.
Systeme, die auf äußere Stimuli reagieren, besitzen somit viele Vorteile gegenüber konventionellen Methoden zur Verabreichung von Medikamenten, insbesondere wenn ihre Aktivierung minimalinvasiv ist und dennoch eine hohe Eindringtiefe in das Gewebe vorweist. Durch die Nutzung von Ultraschall im Fall des smart drug delivery systems, kann die Freisetzung und Wirkung des Medikaments an einem bestimmten Gewebe gezielter induziert werden. Das bedeutet eine Maximierung der Wirkstoffeffizienz und eine Minimierung der möglichen Nebenwirkungen. Somit könnte zukünftig das gesamte Therapieergebnis und die Lebensqualität des Patienten verbessert werden.